Técnica quirúrgica de HoLEP (1)
Información específica para urólogos
En este apartado se describe detalladamente la técnica de la enucleación prostática mediante el láser de holmio (HoLEP; Holmium Laser Enucleation of the Prostate) que empleamos en nuestro grupo. Esta información está dirigida exclusivamente a los urólogos interesados en conocer o aprender el procedimiento quirúrgico.
Introducción
La enucleación del adenoma prostático mediante el láser de holmio (HoLEP) representa uno de los procedimientos endoscópicos más eficaces para el tratamiento de la obstrucción urinaria infravesical ocasionada por el crecimiento prostático. Las excelentes propiedades hemostáticas del láser de holmio minimizan el sangrado quirúrgico y la necesidad de transfusión sanguínea y permiten la rápida retirada de los lavados vesicales. El hecho de poder realizar la cirugía con suero salino fisiológico elimina el riesgo de hiponatremia dilucional. Además, la escasa penetración en los tejidos de este láser reduce la intensidad de la clínica miccional irritativa postoperatoria con respecto a otras fuentes de energía y posibilita la pronta retirada del catéter uretral.
Diversos estudios clínicos han confirmado la seguridad, eficacia y coste-efectividad del procedimiento. La evidencia acumulada por numerosos estudios ha demostrado que HoLEP ocasiona una desobstrucción infravesical inmediata, que el riesgo de reintervención es muy bajo y que la mejoría de los parámetros clínicos es independiente del volumen prostático y se mantiene estable al menos durante 6 años1. Los resultados de los estudios aleatorizados publicados hasta la fecha han demostrado que la mejoría de los índices flujométricos y parámetros sintomáticos lograda tras HoLEP no es significativamente diferente de la obtenida tras la resección transuretral de la próstata (RTU-P) o la adenomectomía abierta. Por contra, HoLEP se ha asociado en todos los estudios publicados a una morbilidad perioperatoria y una estancia hospitalaria significativamente menores2-3.
La principal limitación que presenta HoLEP es su dificultad técnica y por ello, una lenta y prolongada curva de aprendizaje4-6. Esta desventaja asociada a la escasez de centros con experiencia en la técnica ha retrasado la aceptación y difusión del procedimiento en la comunidad urológica. De hecho, en nuestro medio su realización se limita a unos pocos centros con alto volumen de procedimientos.
Desde su descripción original por Gilling y Fraundorfer en 19987, la técnica ha cambiado poco8-10. La mayoría de las variaciones descritas están en relación con el método empleado para evacuar de la vejiga el adenoma enucleado y el desarrollo de un morcelador de tejidos11. De hecho, es una técnica consolidada, bien definida y relativamente rígida ya que admite pocas variaciones. A continuación se describe la técnica que empleamos en nuestro centro, fruto de la evolución quirúrgica lograda con la experiencia después de la realización de más de 3000 procedimientos. Se describe pormenorizadamente cada paso de la cirugía comentando los trucos o maniobras que hemos ido modificando con la experiencia con respecto a la descripción inicial esperando que su lectura pueda ser de utilidad a los urólogos que se inician en la técnica12.
Indicaciones y contraindicaciones
Indicaciones
Contraindicaciones
Haberse realizado una RTU-P de forma previa no es una contraindicación pero sí dificulta su realización y aumenta el riesgo de estenosis de uretra e incontinencia urinaria. La existencia de coxartrosis severa o de imposibilidad para la separación de las caderas es una contraindicación ya que al dificultarse la movilización lateral del endoscopio se imposibilita hallar y seguir el plano de enucleación. La existencia de una microvejiga dificultaría la realización de la morcelación con seguridad. En este caso se podría optar por realizar la enucleación subtotal del adenoma con el láser y la extracción del adenoma empleando la técnica del “champiñón’’ propuesta por Hochreiter11. La presencia de un carcinoma de próstata localmente avanzado dificultaría la diferenciación de los tejidos y hallar adecuadamente el plano de la cápsula prostática.
Material para su realización
En nuestro centro utilizamos material endoscópico de Karl Storz® (Tuttlingen, Alemania) y un generador de láser holmio de 120 W (MOSES Pulse™ 120H) de Lumenis® (Yokneam, Israel) (Figura 1). Aunque se puede realizar la cirugía con potencias de 60 u 80 W, el empleo de un generador de 120 W permite disminuir el tiempo quirúrgico. La utilización de un segundo pedal con unos parámetros preestablecidos entre los que se incluye el aumento de la longitud del pulso facilitan el proceso de coagulación. Empleamos una fibra de láser reesterilizable de 550 μm que acepta potencias de hasta 120 W y permite el tratamiento simultáneo de litiasis vesicales (Figura 2). Para la enucleación se emplea un resectoscopio de doble vaina que consta de un elemento de trabajo modificado por el que se introduce la fibra de láser y una óptica de 30º. Para la morcelación se utiliza un nefroscopio que tiene un canal de trabajo por el que se introduce el morcelador de tejidos VersaCut™ de Lumenis®. Se necesita una torre de endoscopia y una cámara de endourología. Preferimos el empleo de una cámara de endourología con cabezal basculante o pendular ya que ayuda a mantener la orientación espacial durante la disección de los lóbulos laterales. Toda la cirugía se realiza con suero salino como líquido de irrigación.

Figura 1. Generador de láser holmio de 120 W (MOSES Pulse® 120H) de Lumenis®

Figura 2. Fibra láser de 550 μm (SlimLine™ SIS de 550 μm) de Lumenis®
Consideraciones preoperatorias
En los pacientes que siguen tratamiento con acenocumarol el fármaco es sustituido por enoxaparina sódica 3-4 días antes de la intervención. Si no hay contraindicación médica, los fármacos antiagregantes son suspendidos 7 días antes de la cirugía o reemplazados por 100 mg diarios de ácido acetilsalicílico. En los restantes pacientes se realiza profilaxis de trombosis venosa con la administración de 2000 UI diarias de enoxaparina sódica subcutánea.
Previamente a la cirugía obtenemos una muestra de orina que enviamos a cultivar. La profilaxis antimicrobiana que empleamos habitualmente consiste en la administración parenteral de una única dosis de 240 mg de gentamicina justo antes de la anestesia. Si el paciente es portador de una sonda uretral, ha tenido una infección del tracto urinario reciente, está inmunodeprimido o tiene otros factores de riesgo de infección, asociamos la administración de 1 g de amoxicilina-ácido clavulánico cada 8 horas por vía parenteral hasta la retirada postoperatoria de la sonda uretral.
La inmensa mayoría de los procedimientos se realizan bajo anestesia regional asociada a sedación. Aunque en la inmensa mayoría de casos la anestesia es intradural, cuando se prevé que la cirugía puede ser larga se opta por la vía peridural.
Posicionamiento del paciente en quirófano
El paciente se coloca en la posición de litotomía manteniendo las caderas bien separadas y flexionadas. El grado de basculación lateral que precisa el endoscopio en este procedimiento es posiblemente mayor que el que se requiere para la realización de una RTU-P. Una inadecuada colocación del paciente por insuficiente abducción y rotación externa de los muslos impediría hallar el plano de enucleación a nivel de los lóbulos apicales y dificultaría el procedimiento.
Descripción de la técnica
Primera parte: Enucleación prostática
Instrumental
Para realizar la enucleación prostática empleamos un resectoscopio de flujo continuo que consta de una vaina externa (26 Fr), una vaina interna fija o giratoria (24 Fr) y un elemento de trabajo modificado. El elemento de trabajo dispone de un canal interno de 1.5 mm por el que se introduce y se fija la fibra del láser y de una anilla móvil para el pulgar que permite que la fibra del láser pueda ser desplazada fuera y dentro del resectoscopio mediante movimientos idénticos a los de una RTU. Empleamos una fibra láser de 550 μm (SlimLine™ SIS de 550 μm) (Figura 2). La enucleación se suele realizar a máxima potencia (120 W) con unos parámetros relativamente constantes: 2 J de energía y 50-60 Hz de frecuencia. Algunos cirujanos disminuyen la energía a 1.2 J y la frecuencia a 40 Hz durante la disección de los lóbulos apicales con el objetivo de disminuir la potencia y minimizar la transmisión de calor al esfínter externo evitando así su disfunción por lesión térmica. Como sistema de irrigación utilizamos bolsas de 3 litros de suero salino fisiológico situadas 50 cm por encima de la vejiga y conectadas a la vaina externa del resectoscopio mediante un tubo en Y. Habitualmente dejamos que la salida de líquido de irrigación sea por caída libre aunque puede hacerse mediante la conexión a un sistema de aspiración continua. Si la próstata presenta gran tamaño o se prevé que la cirugía va a ser larga, puede ser útil el empleo de un calentador de fluidos para evitar el enfriamiento excesivo del paciente al final de la intervención.
Calibración de la uretra e introducción del resectoscopio
Tras lubricar generosamente la uretra con un gel lubricante hidrosoluble, calibramos el meato uretral y la fosa navicular con un dilatador uretral cónico (15-30 Fr). Si hay una estenosis del meato uretral o se aprecia cierta resistencia a la introducción del dilatador, realizamos una uretrotomía interna ciega a las 12 horarias mediante una hoja de bisturí nº 11 o con un uretrotomo de Otis-Mauermayer. El objetivo es lograr que el resectoscopio pueda ser introducido en la uretra anterior de forma ciega y sin dificultad para evitar el desarrollo postoperatorio de una estenosis de meato. Habitualmente utilizamos un obturador estándar en vez de uno deflectante. Al llegar a la uretra bulbar proseguimos ascendiendo bajo visión directa empleando una óptica estándar de 30º. Si la vejiga está vacía, al llegar a la uretra membranosa podemos identificar la referencia anatómica del esfínter externo. La apertura y cierre secuencial del tubo de irrigación desencadena la contracción del esfínter estriado. Posteriormente se inspecciona la uretra prostática y la vejiga. El número, tamaño y disposición de los lóbulos prostáticos nos permitirá planificar la cirugía (Figura 3). La realización de la cistoscopia permitirá identificar la existencia de litiasis o tumores vesicales, el aspecto de los meatos ureterales y su proximidad al cuello de la vejiga, la capacidad y aspecto de la vejiga, etc.
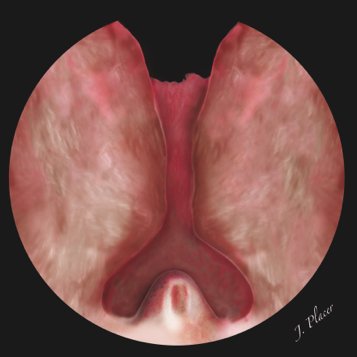
Figura 1. Generador de láser holmio de 120 W (MOSES Pulse® 120H) de Lumenis®
Siguiente página
Técnica quirúrgica de HoLEP (2)